Introduction
- Matériel et outils
La bassine est un accessoire ménager très prisé dans les pays en voie de développement, où elle trouve de multiples usages, principalement alimentaire et pour le linge. Elle sert ainsi de récipient pour collecter et nettoyer de la nourriture (coquillages, légumes, etc.) ; elle permet de transporter le linge sale entre le domicile et le lavoir, avant de le ramener pour le faire sécher.
Le principal lieu de production des bassines est l'Asie du sud-est.Le tube à essai est surtout utilisé en chimie et en biologie. De façon plus anecdotique, des tubes à essai sont parfois utilisés comme soliflores et comme conteneurs pour stocker des épices.
Il est généralement constitué de verre (souvent pyrex) ou en matière plastique (souvent polypropylène).Étape 1 - La manipulation
- Remplir le récipient (bassine, bocal, ...) avec de l'eau et y ajouter l'électrolyte (ici, nous utilisons du sel).
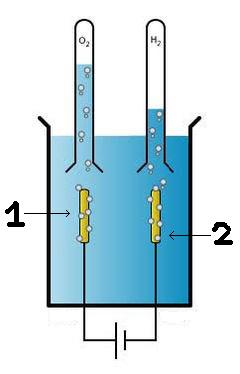
- Prendre les deux clous ou les deux tiges de métal choisies et les placer dans chacun des tubes à essai (le but étant de récupérer l'hydrogène produit par l'électrolyse).
- Brancher la pointe équipée du récupérateur (tube à essai) sur le pôle (-), la cathode, c'est là que l'hydrogène sera récupéré.
- Brancher l'autre pointe équipée du récupérateur (tube à essai) sur l'autre pôle (+), l'anode, c'est là que sera récupéré l'oxygène.
- Attendre et observer.
Que se passe-t-il ?
Comment ça marche ?
Observations : que voit-on ?
Des petites bulles commencent à apparaître sur les tiges de métal : c'est du dioxygène (O2) au pôle (+) et du dihydrogène (H2) au pôle (-).
Au bout d'une heure, s'il n'y a pas assez de gaz dans les tubes, on peut rajouter du sel pour booster la réaction.
Une fois que l'on a récupéré assez d'hydrogène, on peut le faire exploser en approchant la flamme du briquet au moment où on le relâche.
Il est préférable d'utiliser de la soude comme électrolyte.
Explications
Comment sait-on que l'hydrogène est présent ?
Le courant électrique dissocie la molécule d'eau (soit H2O) en ions hydroxyde (OH)- et hydrogène H+ : dans la cellule électrolytique, les ions hydrogène acceptent des électrons à la cathode dans une réaction d'oxydation en formant du dihydrogène gazeux (soit H2), alors qu'une oxydation des ions hydroxyde - qui perdent des électrons donc - se produit à l'anode, ce qui produit l'oxygène (O2).
On constate aussi que le volume de l'hydrogène est deux fois celui de l'oxygène. On utilise une flamme pour constater la présence de l'hydrogène, puisque c'est un gaz très inflammable.
L'électrolyte ?
L'eau pure conduit peu l'électricité, ce qui contraint à l'emploi d'un additif hydrosoluble - électrolyte - dans la cellule d'électrolyse pour « fermer » le circuit électrique (autrement dit, faire en sorte que les potentiels chimiques en jeu permettent la réaction chimique).
L'électrolyte se dissout et se dissocie en cations et anions (c'est-à-dire respectivement des ions chargés positivement et négativement) qui peuvent « porter » le courant. Ces électrolytes sont habituellement des acides, des bases ou des sels minéraux.
Applications : dans la vie de tous les jours
Production d'hydrogène comme carburant du futur.
La combustion d'hydrogène ne crée pas de CO2. Par conséquent il s'agit d'une énergie propre.
En revanche
Dernière modification 17/12/2020 par user:Choupisson débrouillard.
Draft