| (21 révisions intermédiaires par 2 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{Tuto Details | {{Tuto Details | ||
| − | |Main_Picture= | + | |Main_Picture=G_n_rateur_d_hydrog_ne_Sch_ma_hydrog_ne.png |
|Licences=Attribution + Pas d'utilisation commerciale (CC-BY-NC) | |Licences=Attribution + Pas d'utilisation commerciale (CC-BY-NC) | ||
| − | |Description=Par | + | |Description=Par électrolyse de l'eau, obtenir de l'hydrogène et de l'oxygène. Les récupérer et créer de mini explosions néanmoins très impressionnante. ATTENTION mini explosion = volume d'une petite cuillère, au delà (volume d'1/4 de verre) DANGER POUR LES TYMPANS. Ou bien créer une flamme extrêmement chaude si l'on en produit suffisamment et que l'on dispose d'un brûleur adapté. |
| − | Il s'agit là d'un prototype fait avec du matériel simple dont je disposais. C'est améliorable, adaptable, ou l'on peut choisir d'autre méhodes... il existe de nombreux tuto.. | + | Il s'agit là d'un prototype fait avec du matériel simple dont je disposais. C'est améliorable, adaptable, ou l'on peut choisir d'autre méhodes... il existe de nombreux tuto.. L'objectif de ce tuto est de réunir tout ce que j'ai compris et expérimenté en vue d'orienter de nouvelle expérimentation pour ceux que cela interessent. |
Je l'ai conçu dans l'idée de l'intégrer à des parcours énergies. Il s'agirait plus à ce stade d'une maquette d'illustration et de démonstration bien que je pense qu'il soit possible de le réaliser en club, en mini stage ... avec des adolescents. | Je l'ai conçu dans l'idée de l'intégrer à des parcours énergies. Il s'agirait plus à ce stade d'une maquette d'illustration et de démonstration bien que je pense qu'il soit possible de le réaliser en club, en mini stage ... avec des adolescents. | ||
| − | |Disciplines scientifiques=Chemistry, Electricity, Physics | + | |Disciplines scientifiques=Chemistry, Earth Sciences, Electricity, Matter Sciences, Physics |
| − | |Difficulty= | + | |Difficulty=Technical |
|Duration=6 | |Duration=6 | ||
|Duration-type=hour(s) | |Duration-type=hour(s) | ||
| − | |Tags=Hydrogène, énergie, electrolyse, eau, oxygene, électricité, transport | + | |Tags=Hydrogène, énergie, electrolyse, eau, oxygene, électricité, transport, gaz |
}} | }} | ||
{{Introduction | {{Introduction | ||
| Ligne 23 : | Ligne 23 : | ||
{{Materials}} | {{Materials}} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title=Définition des termes | + | |Step_Title=SECURITE |
| − | |Step_Content='''Une Electrolyse de l'eau pour obtenir de l'hydrogène ça marche comment ?''' | + | |Step_Content=<br />{{Warning|Utilisation d'électricité 220V au primaire de l'alimentation, cette partie doit être parfaitement sécurisé d'autant que l'on manipule des liquides. Une terre doit être présente sur l'alimentation !}}{{Warning|L'hydrogène est explosif au contact d'une flamme, les volumes produits doivent être minime. Il y a un risque pour les tympans. En cas de retour de flamme dans le système les bocaux peuvent exploser (le couvercle saute avant que le verre casse mais bon...)}}{{Warning|Afin de minimiser et éviter les retours de flammes vers vos bocaux, Ne JAMAIS PLACER UNE FLAMME DIRECTEMENT AU TUYAU DE SORTIE. |
| + | Utiliser un bulleur ou le volume des gazs sera faible, placer une mousse au tuyau de sortie, voir même ajouter un antiretour à la sortie (solution plus bas), voir même ajouter une soupape sur le bulleur. Si vous traiter des volumes de quelques cl, bulleur et mousse sont suffisant par rapport au danger.}}{{Warning|Utilisation de soude pour l'électrolyte. En faible quantité mais ça reste très corrosif. Si vous faites manipuler des enfants utiliser du bicarbonnate, beaucoup moins efficace et dégrade les électrodes mais ça marche.}}{{Warning|Pour l'électrolyte ne pas utiliser de sel qui produit du dichlore, gaz très toxique, une sorte de gaz moutarde ..}} | ||
| + | }} | ||
| + | {{Tuto Step | ||
| + | |Step_Title=Définition des termes et quelques finesses ou piste de test. | ||
| + | |Step_Content=*'''Une Electrolyse de l'eau pour obtenir de l'hydrogène ça marche comment ?''' | ||
| − | On fait passer de l’électricité dans de l’eau '''(électrolyseur)''', cela a pour effet de casser la molécule d’eau H²0 pour obtenir du dihydrogène H² d’un coté et du dioxygène O² de l’autre. Il faut ensuite pouvoir récupérer ces gazs en sécurité '''(bulleur)'''. | + | On fait passer de l’électricité dans de l’eau '''(électrolyseur)''', cela a pour effet de casser la molécule d’eau H²0 pour obtenir du dihydrogène H² d’un coté et du dioxygène O² de l’autre (2 fois plus de H² que de O²). Il faut ensuite pouvoir récupérer ces gazs en sécurité '''(bulleur)'''. Pour contôler cette électricité on utilise un '''multimètre.''' |
| − | + | <br /> | |
| + | *'''<u>L'alimentation électrique:</u>''' fournit l'électricité en courant continu (dc) au système. Une tension (V) minimum est nécessaire, 1,3 v en théorie mais à priori... 2-3V minimum, plus la tension est basse plus le système sera facile à piloter (courant, chaleur, evaporation..). Le courant (A) est le facteur qui déterminera la quantité de gaz produit. '''Ici j'utilise un 5 V qui peut fournir 17A maximum.''' | ||
| − | + | *<u>'''Le multimètre :'''</u> Il permet de contrôler la puissance du système, On l'utilise en mode ampèremètre il se branche en série à la sortie de l'alimentation ; il est limité à 10A. Si l'on dispose d'une pince Ampèremétrique aucun branchement n'est nécessaire et la limite de courant est bien plus élevée, celà fonctionne par magnétisme. | |
| + | *'''<u>L'Electrolyseur:</u>''' Il est étanche, c'est là que sont produit ces gazs. '''Ce n'est pas le cas ici''' mais on peut récupérer l'hydrogène et l'oxygène séparement. On y trouve : | ||
| − | |||
| + | '''- Les électrodes''' sont les moceaux de métal que l'on trempe dans l'électrolyte et par ou sortira l'électricité. Il y a une électrode + (anode) qui "produit" l'oxygène et une - (cathode) qui "produit" l'hydrogène . Il faut les multiplier pour obtenir un bon résultat et faire en sorte qu'elles soient le plus proche possible sans se toucher, elles doivent être isolées l'une de l'autre. Dans l'idéal on utilise de l'inox ou du graphite (mine de crayon). '''Ici j'utilise du zinc et tiges filetées en fer.''' | ||
| − | ''' | + | Entre ces électrodes se trouvera la tension(V) de l'alimentation. '''Ici 5V .''' |
| − | |||
| + | <u>En cas d'alimentation 12 V:</u> | ||
| − | + | - Cela marchera bien mais cela sera moins gérable... cette tension élevé fera qu'il y a plus de risque que le courant se mette à monter avec le temps... , Le système sera aussi plus puissant, l'électrolyte chauffera plus, il y a aura plus d'évaporation (voir "ce qui fait rater l'expérience"). | |
| + | - Sinon iI est possible de diviser cette tension (voir schéma) en rajoutant entre les + et les - des plaques neutre (connectées à rien). Pour 12 V donc, vous pouvez ajouter 3 plaques neutre entre + et - alors on aura 12/4 soit 3 V entre chaque plaques. | ||
| − | '''- L'électrolyte''' est de l'eau | + | - Sinon il est aussi possible de faire 4 électrolyseurs (sans plaque neutre) cablés en série mais attention au courant qui sera plus élevé... C'est aussi 4* plus de boulot mais potentiellement on produit 4* fois plus d'hydrogène. |
| + | |||
| + | |||
| + | '''- L'électrolyte''' est de l'eau dans laquelle on ajoute une matière qui facilitera la circulation du courant. Eviter le sel car cela produit un gaz toxique et le bicarbonnate qui déteriore les electrodes, (tester les christaux de soude). On peut utiliser de l'eau normal mais c'est moins pure donc plus salissant. '''Ici j'utilise de la soude et de l'eau distillée.''' | ||
Puis ces gazs passe via un tuyau vers le bulleur. | Puis ces gazs passe via un tuyau vers le bulleur. | ||
| + | *'''<u>Le bulleur</u>''' | ||
| − | |||
| + | C'est un élément de sécurité pour le matériel et les personnes. C'est un récipient étanche remplis d'eau qui reçoit les gazs venus de l'électrolyseur. Ils remontent dans l'eau et ressortent via un autre tuyau pour leurs utilisation. En cas de retour de flamme c'est le bulleur qui encaisse et empêche la flamme d'aller jusqu'à l'électrolyseur. Ajout d'une mousse au tuyau de sortie est la sécurité minimum pour éviter que la flamme arrive jusqu'au bulleur. | ||
| + | |Step_Picture_00=G_n_rateur_d_hydrog_ne_ia-ca5098624e95a259dfcb5712ef20a232-px-G_n_rateur_d_hydrog_ne_S1770004.resized.JPG.png | ||
| + | |Step_Picture_01=G_n_rateur_d_hydrog_ne_Sch_ma_hydrog_ne.png | ||
| + | |Step_Picture_02=G_n_rateur_d_hydrog_ne_S1770002.resized.JPG | ||
| + | |Step_Picture_03=G_n_rateur_d_hydrog_ne_electrodeschem.png | ||
| + | |Step_Picture_03_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":-0.11,"width":1123,"height":794,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.53,"scaleY":0.53,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/e/e3/G_n_rateur_d_hydrog_ne_electrodeschem.png","filters":[]},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":120,"top":120,"width":52.75,"height":22.6,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"Texte","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} },{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":484.32,"top":399,"width":208.35,"height":48.82,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"en cas de tension d'alim élevée.","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} }],"height":424,"width":600} | ||
| + | }} | ||
| + | {{Tuto Step | ||
| + | |Step_Title=Utilisation du multimètre | ||
| + | |Step_Content=Pour ce qui suit différentes mesures de l'électricité sont nécessaire. | ||
| − | + | <br /> | |
| + | |||
| + | *'''Mesure du courant A :''' - Avec un multimètre sélecteur en position Adc (ampère, continu), calibre 20A si pas automatique, brancher la fiche rouge sur la bonne borne.Il se cable en série. entre l'alimentation et l'électrolyseur. Vous êtes limité à 10 Ampères sinon vous l'endommagerez ainsi que vos fils. - Avec une pince ampèremétrique c'est plus simple, pas de branchement, pas de limite. Elle fonctionne par magnétisme. Brancher normalement votre alim à l'électrolyseur et venez placer votre pince autour du fil. | ||
| + | |||
| + | *'''Autres mesures:''' | ||
| + | |||
| + | - position ohmètre pour tester l'isolation entre les électrodes. | ||
| + | |||
| + | - position voltmètre pour vérifier la tension au niveau de l'alimentation ou des électrodes. | ||
| + | |Step_Picture_00=G_n_rateur_d_hydrog_ne_S1780006.resized.JPG | ||
| + | |Step_Picture_00_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":0.25,"width":800,"height":450,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.75,"scaleY":0.75,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/2/2e/G_n_rateur_d_hydrog_ne_S1780006.resized.JPG","filters":[]},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":458,"top":34,"width":176.99,"height":22.6,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"AMPEREMETRE","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} }],"height":338,"width":600} | ||
| + | |Step_Picture_01=G_n_rateur_d_hydrog_ne_S1780008.resized.JPG | ||
| + | |Step_Picture_01_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":0.25,"width":800,"height":450,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.75,"scaleY":0.75,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/1/16/G_n_rateur_d_hydrog_ne_S1780008.resized.JPG","filters":[]},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":475,"top":45,"width":88.14,"height":22.6,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"Ohmètre","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} }],"height":338,"width":600} | ||
| + | |Step_Picture_02=G_n_rateur_d_hydrog_ne_S1780007.resized.JPG | ||
| + | |Step_Picture_02_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":0.25,"width":800,"height":450,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.75,"scaleY":0.75,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/d/dc/G_n_rateur_d_hydrog_ne_S1780007.resized.JPG","filters":[]},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":477,"top":70,"width":109.79,"height":22.6,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"Voltmètre","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} }],"height":338,"width":600} | ||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
|Step_Title=Fabrication Alimentation Electrique | |Step_Title=Fabrication Alimentation Electrique | ||
| − | |Step_Content= | + | |Step_Content=Alimentation d'une tour de PC. Voir l'étiquette pour les voltages et ampérages disponibles. Ici j'utilise le 5Vdc qui me permet 18A. |
| + | |||
| + | * Lisez l'étiquette de l'alimentation | ||
| − | + | * Couper tous les connecteurs | |
| + | *Trier les fils par couleur | ||
| + | *Pour le 5V prendre les fils rouges et les connecter à un domino | ||
| + | *Pour le 12 V prendre les fils jaunes et les connecter à un domino | ||
| + | *pour le 0V prendre les fils noirs et les connecter à un domino. | ||
| + | *vérifier vos tensions avec le multimètre. | ||
| + | *Selon les alimentations d'autres connexions peuvent être nécessaire. (rose avec rouge, orange avec marron....) Ajout de résistance, installation d'un interrupteur pour le standby (ou shunter direct ce que j'ai fais). Ici je ne me suis pas embêter mais ça peut valoir le coup même pour d'autres applications. <u>https://www.latelierdugeek.fr/2013/05/11/transformer-une-alimentation-de-pc-en-alimentation-datelier</u> | ||
| + | |Step_Picture_00=G_n_rateur_d_hydrog_ne_S1750001.resized.JPG | ||
| + | |Step_Picture_01=G_n_rateur_d_hydrog_ne_S1780003.resized.JPG | ||
| + | |Step_Picture_02=G_n_rateur_d_hydrog_ne_schema_alim.png | ||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
|Step_Title=Fabrication Electrode - méthode 1 | |Step_Title=Fabrication Electrode - méthode 1 | ||
| − | |Step_Content=Cette méthode donne une électrode plus petite, nécessite moins de matériel et est plus rapide à la fabrication. Néanmoins elle est plus fastidieuse à fabriquer car les électrodes sont plus proches et les risques de court circuit sont important, l'entretien y est compliqué et elle est plus fragile. | + | |Step_Content=Cette méthode donne une électrode plus petite, nécessite moins de matériel et est plus rapide à la fabrication. Néanmoins elle est plus fastidieuse à fabriquer car les électrodes sont plus proches et les risques de court circuit sont important, l'entretien y est compliqué et elle est plus fragile. En 12V c'est pas gérable, le courant s'emballe...nettoyage toutes les 10 mins(dans mon cas). Vous pouvez voir sur la photo les dépot entre les plaques qui finissent par provoquer la montée subite du courant (courtcircuit) |
| + | |||
| + | |||
| + | Personnellement j'utiliserais cette méthode dans le cas ou j'ai besoin de rajouter des plaques neutres (si tension d'alim 12V ou plus) | ||
Je ne vais pas develloper cette métode. Simplement quelques photos et ce lien vidéo:https://www.youtube.com/watch?v=Uz0REdjpJtI | Je ne vais pas develloper cette métode. Simplement quelques photos et ce lien vidéo:https://www.youtube.com/watch?v=Uz0REdjpJtI | ||
| + | |Step_Picture_00=G_n_rateur_d_hydrog_ne_S1760009.resized.JPG | ||
| + | |Step_Picture_01=G_n_rateur_d_hydrog_ne_S1760006.resized.JPG | ||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title=Fabrication | + | |Step_Title=Fabrication Electrolyseur- méthode 2 |
| − | |Step_Content=Cette méthode à l'avantage d'être plus pédagogique car le système est plus visuel, plus robuste, l'entretien y | + | |Step_Content=Cette méthode à l'avantage d'être plus pédagogique car le système est plus visuel, plus robuste, et le réglage, l'entretien y sont plus simples. |
| − | + | ||
| − | |||
| − | |||
| − | |||
| + | Matériel : Grand pot de confiture, tefelon, tuyau30cm, une pièce en bois (isolante) 1-2cm d'épaisseur, à peu près 8 plaques de métal, 2 ecrous/rondelles par plaque + 2 écrous/rondelles pour pièce de maintient + 2écrous et '''rondelles plastique isolantes''' pour le couvercle. | ||
| − | + | <br />'''ELECTRODE''' | |
| + | *Le dimensionnement de votre électrode dépendera des dimensions de votre pot. | ||
| − | '' | + | - D'abord sa largeur pour les plaques de métal et pièce de maintient qui vous donneront la tolérance pour l'entraxe de vos tiges filetées. |
| + | - Puis la profondeur du pot pour la longueur des tiges filetées + 3- 5cm. | ||
| − | |||
| − | + | Dans mon cas j'ai maximisé la largeur de mes plaques (plus grande que l'entraxe des tiges) ce qui multiplie les trous par 2, c'est pas obligatoire. | |
| + | <br /> | ||
| − | ''' | + | *Une fois vos dimensions déterminées percer votre pièce en bois à l'entraxe et au diamètre de vos tiges. Cette pièce permet le maintient du parallélisme entre les électrodes, l'ensemble est plus robuste que si seul le couvercle du pot assurait le maintient. |
| + | *Faite de même sur le couvercle du pot mais en perçant plus large que les tiges. Si elles font 6mm de diamètre percez à 10. Cela permet que les tiges ne rentrent pas en contact avec le couvercle qui est métallique et donc conducteur ce qui provoquerait un court circuit. | ||
| + | *Mettre de la colle sur la pièce de maintient (elle servira d'étanchéité), glisser vos tiges filetées à travers cette pièce et le couvercle. Faire dépasser de 3cm minimum au dessus du couvercle. Couvercle et pièce de maintient sont maintenant collé avec les tiges au travers, il faut maintenant serrer le tout avec écrou rondelle. ATTENTION coté couvercle, utiliser des pièces en plastiques isolante comme rondelle. | ||
| + | *A ce stade cela pourrait fonctionner mais pas idéalement.Il faut maintenant installer nos plaques pour multiplier les surfaces d'échanges. | ||
| + | *Découper vos plaques à dimensions. | ||
| + | *Reporter sur leur diamètre l'entraxe des tiges pour percer. centrer ! | ||
| + | *Sur chaque plaque faire un trou au diamètre de la tige (6) et un à 10 voir plus grand. Un trou servira à la fixation l'autre à laisser passer l'autre tige sans la toucher. | ||
| + | *Maintenant il faut les fixer en quinquonce avec les écrous (2 écrous par plaque). Une + sur une tige, une - sur l'autre tige. Plus elles sont proches mieux c'est.Placer en le maximum. '''TESTER L'ISOLATION ENTRE VOS ELECTRODE ('''multimètre en position ohmètre) | ||
| − | |||
| − | + | '''TUYAU DE RECUPERATION DES GAZS''' | |
| − | + | *Vous pouvez le faire passer dans la pièce de maintient (plus solide) ou juste par le couvercle.Percer au diamètre, enfiler le tuyau à l'intérieur. coller dessus/dessous. Pourquoi pas utiliser une valve de chambre air pour déconnecter le tuyau (voir bulleur) | |
| − | + | '''FINITION''' | |
| + | *Etanchéité : Mettre du tefelon sur le filetage du pot (sens horaire) | ||
| + | *Connecter vos fils électriques aux tiges filetées . Rondelle/fil/rondelle écrou.Serrer. | ||
| − | ''' | + | <br /> |
| + | |Step_Picture_00=G_n_rateur_d_hydrog_ne_S1750003.resized.JPG | ||
| + | |Step_Picture_00_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":0.25,"width":640,"height":360,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.94,"scaleY":0.94,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/e/e0/G_n_rateur_d_hydrog_ne_S1750003.resized.JPG","filters":[]},{"type":"wfellipse","version":"3.5.0","originX":"center","originY":"center","left":297.44,"top":199.24,"width":27.4,"height":27.4,"fill":"rgba(255,0,0,0)","stroke":"#FF0000","strokeWidth":2,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"rx":13.700086610148386,"ry":13.700086610148386},{"type":"wfarrow2line","version":"3.5.0","originX":"center","originY":"center","left":229,"top":197,"width":100,"height":0,"fill":"rgba(255,0,0,0)","stroke":"#FF0000","strokeWidth":4,"strokeDashArray":null,"strokeLineCap":"round","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"x1":-50,"x2":50,"y1":0,"y2":0,"x2a":30,"y2a":-8,"x2b":30,"y2b":8},{"type":"wfarrow2circle","version":"3.5.0","originX":"center","originY":"center","left":179,"top":197,"width":16,"height":16,"fill":"#aaa","stroke":"#666","strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":0.5,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"radius":8,"startAngle":0,"endAngle":6.283185307179586},{"type":"wfarrow2circle","version":"3.5.0","originX":"center","originY":"center","left":279,"top":197,"width":16,"height":16,"fill":"#aaa","stroke":"#666","strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":0.5,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"radius":8,"startAngle":0,"endAngle":6.283185307179586},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":126.57,"top":191,"width":161.84,"height":127.46,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"trous trop petits, les tiges filetées vont toucher le couvercle","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} },{"type":"wfellipse","version":"3.5.0","originX":"center","originY":"center","left":353.76,"top":202.24,"width":31.16,"height":31.16,"fill":"rgba(255,0,0,0)","stroke":"#FF0000","strokeWidth":2,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"rx":15.581906883359324,"ry":15.581906883359324}],"height":338,"width":600} | ||
| + | |Step_Picture_01=G_n_rateur_d_hydrog_ne_S1750004.resized.JPG | ||
| + | |Step_Picture_02=G_n_rateur_d_hydrog_ne_S1750005.resized.JPG | ||
| + | |Step_Picture_03=G_n_rateur_d_hydrog_ne_S1760003.resized.JPG | ||
| + | |Step_Picture_03_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":0.25,"width":800,"height":450,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.75,"scaleY":0.75,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/a/a5/G_n_rateur_d_hydrog_ne_S1760003.resized.JPG","filters":[]},{"type":"wfellipse","version":"3.5.0","originX":"center","originY":"center","left":401.57,"top":184.43,"width":59.53,"height":59.53,"fill":"rgba(255,0,0,0)","stroke":"#FF0000","strokeWidth":2,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"rx":29.767065684400883,"ry":29.767065684400883},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":474.57,"top":95,"width":193.87,"height":101.25,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"trou plus large pour que cette tige ne touche pas la plaque","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} }],"height":338,"width":600} | ||
| + | |Step_Picture_04=G_n_rateur_d_hydrog_ne_S1760001.resized.JPG | ||
| + | |Step_Picture_04_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":0.25,"width":800,"height":450,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.75,"scaleY":0.75,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/9/93/G_n_rateur_d_hydrog_ne_S1760001.resized.JPG","filters":[]},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":94.03,"top":156.15,"width":186.96,"height":310.98,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1.02,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"Il est possible de plus rapprocher les plaques en utilisant moins d'écrou, cela dépend de l'épaisseur de vos écrou... plus fastidieux..\nA vous de comprendre la technique.. ;)","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} }],"height":338,"width":600} | ||
| + | |Step_Picture_05=G_n_rateur_d_hydrog_ne_S1770001.resized.JPG | ||
| + | |Step_Picture_05_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":0.25,"width":800,"height":450,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.75,"scaleY":0.75,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/7/75/G_n_rateur_d_hydrog_ne_S1770001.resized.JPG","filters":[]},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":521.69,"top":224,"width":155.6,"height":179.9,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"Pièce isolante afin d'éviter que les tiges soient en contacte avec le couvercle métallique","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} },{"type":"wfarrow2line","version":"3.5.0","originX":"center","originY":"center","left":396.5,"top":158.5,"width":77,"height":9,"fill":"rgba(255,0,0,0)","stroke":"#FF0000","strokeWidth":4,"strokeDashArray":null,"strokeLineCap":"round","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"x1":38.5,"x2":-38.5,"y1":-4.5,"y2":4.5,"x2a":-17.70649019725613,"y2a":10.12405103845926,"x2b":-19.563974943903226,"y2b":-5.767762905076998},{"type":"wfarrow2circle","version":"3.5.0","originX":"center","originY":"center","left":435,"top":154,"width":16,"height":16,"fill":"#aaa","stroke":"#666","strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":0.5,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"radius":8,"startAngle":0,"endAngle":6.283185307179586},{"type":"wfarrow2circle","version":"3.5.0","originX":"center","originY":"center","left":358,"top":163,"width":16,"height":16,"fill":"#aaa","stroke":"#666","strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":0.5,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"radius":8,"startAngle":0,"endAngle":6.283185307179586},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":123,"top":120,"width":180.99,"height":75.03,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"Soit :\nfil 1.5mm²: 16A\nfil 2.5mm²: 20A","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} }],"height":338,"width":600} | ||
| + | }} | ||
| + | {{Tuto Step | ||
| + | |Step_Title=Fabrication du bulleur | ||
| + | |Step_Content=1 petit pot de confiture, 2 valves de chambres à air, un tuyau 5-10cm, un tuyau 30cm du tefelon | ||
| − | + | <br /> | |
| − | + | *Selon vos valves : Grande, il faut la percer. Petite elle peut servir d'antiretour (de flamme) pour le tuyau de sortie. Attention tête en bas, soufflez dedans pour tester. | |
| + | *Percer le couvercle au diamètre de vos valves, insérer à mi chemin, coller dessus/dessous. | ||
| + | *Connecter à une valve coté intérieur le tuyau 5-10cm qui plongera dans l'eau.C'est l'arrivée des gazs depuis l'electrolyseur. | ||
| − | + | *Connecter à une valve coté extérieur le tuyau 30cm pour qu'il aille du bulleur jusqu'a votre expérience (petit pot d'eau savonneuse ou bruleur ou...) | |
| + | *insérer un petit bout de mousse au bout du tuyau (anti retour de flamme) | ||
| + | *Etanchéité : Tefelon (sens horaire) sur le filetage du pot. | ||
| + | *Remplir d'eau le bulleur sans immerger la sortie des gazs. | ||
| + | |Step_Picture_00=G_n_rateur_d_hydrog_ne_S1760010.resized.JPG | ||
| + | |Step_Picture_00_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":0,"top":0.25,"width":800,"height":450,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.75,"scaleY":0.75,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/e/ec/G_n_rateur_d_hydrog_ne_S1760010.resized.JPG","filters":[]},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":394.82,"top":121,"width":247.34,"height":101.25,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"valves de chambre à air. Facultatif mais pratique si tuyau adapté.\n","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} },{"type":"wfellipse","version":"3.5.0","originX":"center","originY":"center","left":398.69,"top":225.94,"width":36.71,"height":117.15,"fill":"rgba(255,0,0,0)","stroke":"#FF0000","strokeWidth":2,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"rx":18.357447666681235,"ry":58.577291286885234},{"type":"textbox","version":"3.5.0","originX":"center","originY":"center","left":382.39,"top":305,"width":326.17,"height":48.82,"fill":"#FF0000","stroke":"#FF0000","strokeWidth":1,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":1,"scaleY":1,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"text":"cette valve est un antiretour, efficacité non testé....","fontSize":20,"fontWeight":"normal","fontFamily":"sans-serif","fontStyle":"normal","lineHeight":1.16,"underline":false,"overline":false,"linethrough":false,"textAlign":"left","textBackgroundColor":"","charSpacing":0,"minWidth":20,"splitByGrapheme":false,"styles":{} }],"height":338,"width":600} | ||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title= | + | |Step_Title=Composition de l'électrolyte |
| − | |Step_Content= | + | |Step_Content=Proportion à titre indicatif.. |
<br /> | <br /> | ||
| − | * | + | *Revérifier l'isolation (ohmètre) entre vos deux électrodes |
| − | * | + | *Connectez votre votre circuit électrique en y placant votre ampèremère |
| − | + | ||
| + | Un grand pot de confiture contient à peu près 700ml. | ||
| + | |||
| + | * un ratio soude/eau entre 1-4% semble correct. Cela dépend aussi si vous utilisez de l'eau distillée (moins conductrice) ou pas.. | ||
| + | |||
| + | *Verser 600ml d'eau distillée. L'eau normal fait l'affaire mais le systeme s'encrasse plus vite. | ||
| + | *Rajouter 5ml de soude, mélanger | ||
| + | *Immerger vos électrodes | ||
| + | *Le tout doit recouvrir les électrodes mais ne pas noyer le tuyau de sortie. à vous d'ajuster. Moins il y a d'air dans le pot mieux c'est (temps de purge cf dans la suite). | ||
| + | *Mettre sous tension (si ça coupe cf "problèmes?") | ||
| + | *La réaction commence, vous devriez avoir 3-4 amperes pour une alim pouvant ici 17A. | ||
| + | *Rajouter 1-2-3-4 ml de soude pour atteindre 7 Ampère. | ||
| + | *Il faut garder une marge car avec le temps le courant peut monter. | ||
| + | *ça y est c'est près, fermez bien votre pot. | ||
| + | * | ||
| + | *Pour aller plus loin, je conseille d'aller voir ce site ou ils listent les électrolytes avec avantages/inconvénients https://www.generateurhho.com/conseils-technique-truc-astuces/les-differents-electrolytes<br /> | ||
| + | |Step_Picture_00=G_n_rateur_d_hydrog_ne_S1780004.resized.JPG | ||
| + | }} | ||
| + | {{Tuto Step | ||
| + | |Step_Title=Assemblage et Test | ||
| + | |Step_Content=Connecter le tuyau de l'électrolyseur au bulleur, fermer bien vos pots. Plonger le tuyau de sortie du bulleur dans un petit pot d'eau savoneuse accompagner d'une petite cuillère. | ||
| − | * | + | *Mettre sous tension. dès lors surveiller l'ampérage. |
| − | * | + | *Des bulles apparaissent dans l'électrolyseur puis dans le bulleur puis dans l'eau savonneuse. |
| − | + | *Dans une petite ceuillère récupérer des bulles.Placer sur une flamme. Les bulles éclates mais il ne se passe rien et c'est normal car elles ne contiennent pas encore d'hydrogène, le système n'a pas encore purgé son air. | |
| − | * | + | *Renouveller toutes les 15 secondes, au bout d'un certain temps on détecte une mini explosion , elle s'amplifiera jusqu'a devenir très surprenante !! |
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title=Utilisation | + | |Step_Title=Utilisation dans le temps |
| − | |Step_Content= | + | |Step_Content=*Les électrodes + et - se dégradent ou se salissent différemment. |
| + | *Le courant monte avec le temps, c'est normal. (surtout en 12V) | ||
| + | *La température de l'électrolyseur monte, c'est normal (d'autant plus en 12 V). | ||
| + | *Le niveau d'eau monte dans le bulleur , c'est normal c'est du à l'évaporation dans l'électrolyseur (d'autant plus en 12V). | ||
| + | *L'ampérage dépasse les 10 A (d'autant plus en 12 V). si vous n'avez pas de pince ampèremétrique, couper sous peine d'endommager votre multimètre. | ||
| + | *Le courant monte rapidemement ? on s'approche du court circuit à cause de l'encrassememnt, des christaux qui se forment. | ||
| + | *Le courant s'approche de la limite de l'alimentation, couper. | ||
| + | *NETTOYER , en électrolisant dans de l'eau pure pendant 30s-60s. | ||
| + | *Verifier l'isolation entre vos 2 électrodes. | ||
| + | |Step_Picture_00=G_n_rateur_d_hydrog_ne_S1780001.resized.JPG | ||
| + | }} | ||
| + | {{Tuto Step | ||
| + | |Step_Title=Pour aller plus loin | ||
| + | |Step_Content=Il est possible de multiplier les électrolyseurs qu'on relie au même bulleur afin de récupérer plus d'hydrogène. Ainsi en rajoutant un bruleur au tuyau de sortie on peut faire une flamme en continu à très haute température. | ||
| − | ' | + | Utilisation d'un gel déboucheur à la place de la lessive de soude. Cela crée une mousse stockable (dans ce cas ne pas utiliser le bulleur, en tous cas ne pas faire passer la mousse par de l'eau) |
| − | '' | + | Recombiner ces gazs pour reformer de l'eau ? et fabriquer le l'électricité ? pile à combustible ... mais je crois que ça necessite d'avoir H et O séparément. |
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title= | + | |Step_Title=En très simple pour fabrication avec des enfants |
| − | + | |Step_Content=-Electrodes : crayon de papier | |
| + | |||
| + | - Electrolyte : eau du robinet + bicarbonnate bien mélangé | ||
| + | |||
| + | - Alimentation : pile 9 V ou une vrai alimentation. | ||
| + | |||
| + | - mettre une flamme directement au dessus du récipient (a tester) | ||
| + | }} | ||
| + | {{Notes | ||
| + | |Observations=L'utilisation du 12 V entre les électrodes permets d'accentuer certains phénomènes qui sont problématiques mais interessant à observer .... | ||
| + | |||
| + | |||
| + | LES GAZS | ||
| + | |||
| + | - Les gazs circulent, ils remontent dans l'eau | ||
| + | |||
| + | - Il y a une pression, cela permet la circulation dans les tuyaux qu'ils aillent vers le haut ou vers le bas (hydrogène plus léger que l'air il devrait rester coincer lorsque le tuyau part vers le bas...). Si l'on bouche le tuyau de sortie, il n'y a plus de bulle dans le bulleur, la pression monte et l'étanchéiter est mise à l'épreuve. | ||
| + | |||
| + | -Sur les électrodes + et - il y a respectivement des bulles plus ou moins grosses qui remontent plus ou moins vite. Pas sure qu'on puisse en tirer de bonne conclusion mais vus que l'on produit 2* plus d'hydrogène que d'oxygène... que l'hydrogène est plus léger que l'oxygène... | ||
| + | |||
| + | |||
| + | L' EXPLOSION | ||
| + | |||
| + | - Au début les bulles n'explosent pas puis au bout d'un moment... (purge de l'air..) | ||
| − | + | - L'explosion est très impressionante comparé au volume d'une petite cuillère. | |
| + | - On ne voit pas de flamme | ||
| − | - | + | - On sent un souffle de l'explosion |
| − | |||
| − | + | COMPORTEMENT DU SYSTEME | |
| − | |||
| − | - | + | - L'eau ne baisse pas dans l'électrolyseur (en fait si mais c'est très lent) et pourtant on récupère de bon volume de gaz .... |
| − | - | + | - Avec le temps les électrodes + et - prennent un aspect différent. |
| − | - | + | - Les températures changent |
| − | - | + | - Les niveaux d'eau changent |
| − | - | + | - Le courant électrique change. |
<br /> | <br /> | ||
| − | + | |Avertissement=-Au démarrage mon alim se coupe : c'est à cause du pic de courant au démarrage. Solution: mettre en route l'alimentation avant de la plonger doucement dans l'électrolyte. Ou modifier son alimentation... (ajout d'un condensateur ? d'un rhéostat ?) | |
| − | + | ||
| − | | | + | - L'électrolyse fonctionne mais il n'y a pas de bulles dans le bulleur: Outre un tuyau bouché, il n'y pas suffisamment de pression de gaz pour contrer la pression de l'eau dans le bulleur ou la résistance au passage des gazs; vérifier l'étanchéité de l'électrolyseur et/ou raccourcisser le tuyau arrivant dans le bulleur. Souvent les 2 sont liés, la pression de l'eau au dessus du tuyau dans le bulleur est trop importante pour l'étanchéité. (Pour tester l'étanchéité vous pouvez plonger le tout dans de l'eau pendant le fonctionnement,..) |
| − | + | ||
| + | - Plus de bulle dans le bulleur, de l'eau à la sortie ? Trop d'eau dans le bulleur , le tuyau de sortie est noyé.Cela peut être du à l'évaporation dut à la chaleur dans l'électrolyseur puis à la condensation dans le bulleur qui fait monter le niveau.. | ||
| + | |||
| + | -L'alimentation fonctionne mais l'électrolyse ne fait plus de bulle : outre un problème de connexion le court circuit est atteind. Le courant choisit le chemin le plus facile et ne passe plus dans l'eau. Nettoyer en électrolisant de l'eau pure. vérifier l'isolation des électrodes. | ||
| + | |Applications=* Pour les bricoleurs qui ajoutent ces systèmes à leur voiture ... | ||
| + | |||
| + | * Pour le stockage d'énergie ( surproduction d'électricité , éolien, solaire), par la suite on refait de l'électricité grace à une pile à combustible. | ||
| + | |||
| + | * Voiture à hydrogène, via pile à combustible pour moteur électrique. | ||
| + | * Applications industrielle. | ||
| + | |Notes=L'esprit sorcier : | ||
| − | + | https://www.youtube.com/watch?v=dUv3U9w1xz4 | |
| − | + | Très bien présenté et pédagogique MAIS bon il présente l'hydrogène par électrolyse comme "hydrogène décarbonné".. mouais.. et la question de comment on produit l'électricité ? De plus les énergies électriques dites "vertes", à un prix abordable j'insiste, reposent toujours sur la même chose le pétrole... les métaux qui sont légions dans ces technologies on va les chercher comment ? Il pourrait mettre un peu plus de nuance tout de même | |
| − | + | C'est un peu trop "croissance verte" et technocentré mais c'est mon avis. A la fin ça nuance un peu mais bon faut aller au bout de la vidéo. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | Alimentation tour de PC | |
| − | - | + | <u>https://www.latelierdugeek.fr/2013/05/11/transformer-une-alimentation-de-pc-en-alimentation-datelier</u> |
| − | |||
| − | + | Vidéo générateur hydrogène fait maison + quelques infos en chimie | |
| − | + | https://www.youtube.com/watch?v=Uz0REdjpJtI | |
| − | |||
| + | Electrolyte et autres (pour aller loin..) | ||
| − | - | + | https://www.generateurhho.com/conseils-technique-truc-astuces/les-differents-electrolytes |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | Applications industrielle et autres: | |
| − | + | https://fr.wikipedia.org/wiki/Hydrog%C3%A8ne | |
}} | }} | ||
{{Tuto Status | {{Tuto Status | ||
| − | |Complete= | + | |Complete=Published |
}} | }} | ||
Version actuelle datée du 11 mars 2023 à 10:52
Il s'agit là d'un prototype fait avec du matériel simple dont je disposais. C'est améliorable, adaptable, ou l'on peut choisir d'autre méhodes... il existe de nombreux tuto.. L'objectif de ce tuto est de réunir tout ce que j'ai compris et expérimenté en vue d'orienter de nouvelle expérimentation pour ceux que cela interessent.
Je l'ai conçu dans l'idée de l'intégrer à des parcours énergies. Il s'agirait plus à ce stade d'une maquette d'illustration et de démonstration bien que je pense qu'il soit possible de le réaliser en club, en mini stage ... avec des adolescents.Sommaire
- 1 Introduction
- 2 Étape 1 - SECURITE
- 3 Étape 2 - Définition des termes et quelques finesses ou piste de test.
- 4 Étape 3 - Utilisation du multimètre
- 5 Étape 4 - Fabrication Alimentation Electrique
- 6 Étape 5 - Fabrication Electrode - méthode 1
- 7 Étape 6 - Fabrication Electrolyseur- méthode 2
- 8 Étape 7 - Fabrication du bulleur
- 9 Étape 8 - Composition de l'électrolyte
- 10 Étape 9 - Assemblage et Test
- 11 Étape 10 - Utilisation dans le temps
- 12 Étape 11 - Pour aller plus loin
- 13 Étape 12 - En très simple pour fabrication avec des enfants
- 14 Comment ça marche ?
- 15 Éléments pédagogiques
- 16 Commentaires
Introduction
A l' heure de la transition Energétique nous parlons beaucoup de l'hydrogène. Or l'hydrogène n'existe pas à l'état pure sur terre. Pour en obtenir on doit l'extraire de molécules en contenant déjà. Notre industrie l'extrait principalement de ressources fossiles (95% de la production mondiale) notamment par le craquage du méthane (CH4) en le mettant dans de l'eau chauffée à près de 1000°C ce qui demande beaucoup d'énergie et qui en plus rejette beaucoup de carbonne (C). Une autre façon beaucoup moins répendu, très cher mais efficace et potentiellement moins polluante consiste à aller le chercher dans l'eau (H²O) par électrolyse. Potentiellement moins émettrice de C0² car tout dépend de la provenance de l'électricité qui sert à l'électrolyse (et là il y a aussi tout un sujet..). Il existe d'autres méthodes pour avoir de l'hydrogène mais pour le moment totalement anecdotiques.
Le rendement et le coût de la production d'hydrogène n'est franchement pas un avantage donc il est judicieux de se poser la question de à quoi va til servir ? Mettre de l'hydrogène partout n'est souvent pas le premier choix intelligent à faire.
Étape 1 - SECURITE
Étape 2 - Définition des termes et quelques finesses ou piste de test.
- Une Electrolyse de l'eau pour obtenir de l'hydrogène ça marche comment ?
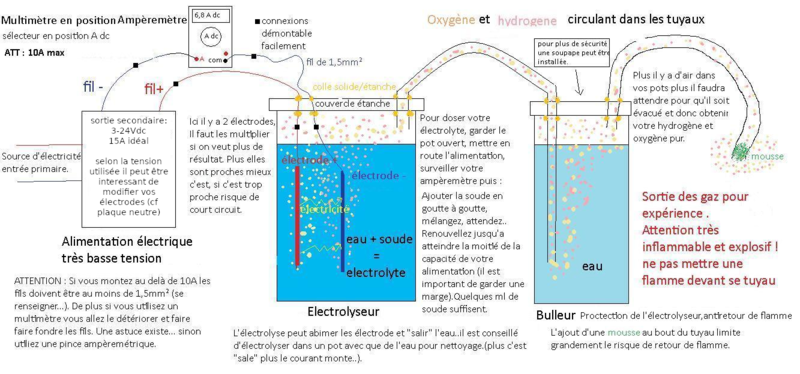
On fait passer de l’électricité dans de l’eau (électrolyseur), cela a pour effet de casser la molécule d’eau H²0 pour obtenir du dihydrogène H² d’un coté et du dioxygène O² de l’autre (2 fois plus de H² que de O²). Il faut ensuite pouvoir récupérer ces gazs en sécurité (bulleur). Pour contôler cette électricité on utilise un multimètre.
- L'alimentation électrique: fournit l'électricité en courant continu (dc) au système. Une tension (V) minimum est nécessaire, 1,3 v en théorie mais à priori... 2-3V minimum, plus la tension est basse plus le système sera facile à piloter (courant, chaleur, evaporation..). Le courant (A) est le facteur qui déterminera la quantité de gaz produit. Ici j'utilise un 5 V qui peut fournir 17A maximum.
- Le multimètre : Il permet de contrôler la puissance du système, On l'utilise en mode ampèremètre il se branche en série à la sortie de l'alimentation ; il est limité à 10A. Si l'on dispose d'une pince Ampèremétrique aucun branchement n'est nécessaire et la limite de courant est bien plus élevée, celà fonctionne par magnétisme.
- L'Electrolyseur: Il est étanche, c'est là que sont produit ces gazs. Ce n'est pas le cas ici mais on peut récupérer l'hydrogène et l'oxygène séparement. On y trouve :
- Les électrodes sont les moceaux de métal que l'on trempe dans l'électrolyte et par ou sortira l'électricité. Il y a une électrode + (anode) qui "produit" l'oxygène et une - (cathode) qui "produit" l'hydrogène . Il faut les multiplier pour obtenir un bon résultat et faire en sorte qu'elles soient le plus proche possible sans se toucher, elles doivent être isolées l'une de l'autre. Dans l'idéal on utilise de l'inox ou du graphite (mine de crayon). Ici j'utilise du zinc et tiges filetées en fer.
Entre ces électrodes se trouvera la tension(V) de l'alimentation. Ici 5V .
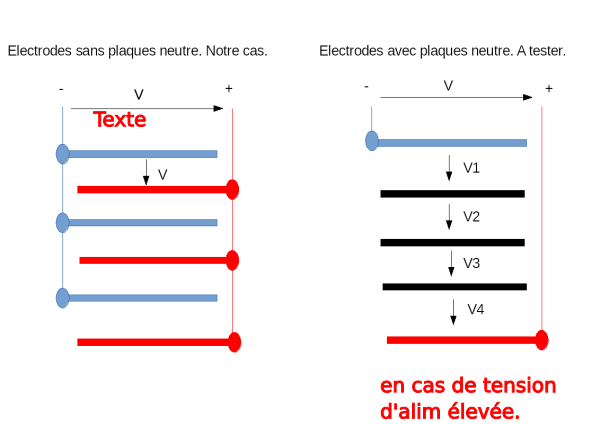
En cas d'alimentation 12 V:
- Cela marchera bien mais cela sera moins gérable... cette tension élevé fera qu'il y a plus de risque que le courant se mette à monter avec le temps... , Le système sera aussi plus puissant, l'électrolyte chauffera plus, il y a aura plus d'évaporation (voir "ce qui fait rater l'expérience").
- Sinon iI est possible de diviser cette tension (voir schéma) en rajoutant entre les + et les - des plaques neutre (connectées à rien). Pour 12 V donc, vous pouvez ajouter 3 plaques neutre entre + et - alors on aura 12/4 soit 3 V entre chaque plaques.
- Sinon il est aussi possible de faire 4 électrolyseurs (sans plaque neutre) cablés en série mais attention au courant qui sera plus élevé... C'est aussi 4* plus de boulot mais potentiellement on produit 4* fois plus d'hydrogène.
- L'électrolyte est de l'eau dans laquelle on ajoute une matière qui facilitera la circulation du courant. Eviter le sel car cela produit un gaz toxique et le bicarbonnate qui déteriore les electrodes, (tester les christaux de soude). On peut utiliser de l'eau normal mais c'est moins pure donc plus salissant. Ici j'utilise de la soude et de l'eau distillée.
Puis ces gazs passe via un tuyau vers le bulleur.
- Le bulleur
C'est un élément de sécurité pour le matériel et les personnes. C'est un récipient étanche remplis d'eau qui reçoit les gazs venus de l'électrolyseur. Ils remontent dans l'eau et ressortent via un autre tuyau pour leurs utilisation. En cas de retour de flamme c'est le bulleur qui encaisse et empêche la flamme d'aller jusqu'à l'électrolyseur. Ajout d'une mousse au tuyau de sortie est la sécurité minimum pour éviter que la flamme arrive jusqu'au bulleur.
Étape 3 - Utilisation du multimètre
Pour ce qui suit différentes mesures de l'électricité sont nécessaire.
- Mesure du courant A : - Avec un multimètre sélecteur en position Adc (ampère, continu), calibre 20A si pas automatique, brancher la fiche rouge sur la bonne borne.Il se cable en série. entre l'alimentation et l'électrolyseur. Vous êtes limité à 10 Ampères sinon vous l'endommagerez ainsi que vos fils. - Avec une pince ampèremétrique c'est plus simple, pas de branchement, pas de limite. Elle fonctionne par magnétisme. Brancher normalement votre alim à l'électrolyseur et venez placer votre pince autour du fil.
- Autres mesures:
- position ohmètre pour tester l'isolation entre les électrodes.
- position voltmètre pour vérifier la tension au niveau de l'alimentation ou des électrodes.
Étape 4 - Fabrication Alimentation Electrique
Alimentation d'une tour de PC. Voir l'étiquette pour les voltages et ampérages disponibles. Ici j'utilise le 5Vdc qui me permet 18A.
- Lisez l'étiquette de l'alimentation
- Couper tous les connecteurs
- Trier les fils par couleur
- Pour le 5V prendre les fils rouges et les connecter à un domino
- Pour le 12 V prendre les fils jaunes et les connecter à un domino
- pour le 0V prendre les fils noirs et les connecter à un domino.
- vérifier vos tensions avec le multimètre.
- Selon les alimentations d'autres connexions peuvent être nécessaire. (rose avec rouge, orange avec marron....) Ajout de résistance, installation d'un interrupteur pour le standby (ou shunter direct ce que j'ai fais). Ici je ne me suis pas embêter mais ça peut valoir le coup même pour d'autres applications. https://www.latelierdugeek.fr/2013/05/11/transformer-une-alimentation-de-pc-en-alimentation-datelier
Étape 5 - Fabrication Electrode - méthode 1
Cette méthode donne une électrode plus petite, nécessite moins de matériel et est plus rapide à la fabrication. Néanmoins elle est plus fastidieuse à fabriquer car les électrodes sont plus proches et les risques de court circuit sont important, l'entretien y est compliqué et elle est plus fragile. En 12V c'est pas gérable, le courant s'emballe...nettoyage toutes les 10 mins(dans mon cas). Vous pouvez voir sur la photo les dépot entre les plaques qui finissent par provoquer la montée subite du courant (courtcircuit)
Personnellement j'utiliserais cette méthode dans le cas ou j'ai besoin de rajouter des plaques neutres (si tension d'alim 12V ou plus)
Je ne vais pas develloper cette métode. Simplement quelques photos et ce lien vidéo:https://www.youtube.com/watch?v=Uz0REdjpJtI
Étape 6 - Fabrication Electrolyseur- méthode 2
Cette méthode à l'avantage d'être plus pédagogique car le système est plus visuel, plus robuste, et le réglage, l'entretien y sont plus simples.
Matériel : Grand pot de confiture, tefelon, tuyau30cm, une pièce en bois (isolante) 1-2cm d'épaisseur, à peu près 8 plaques de métal, 2 ecrous/rondelles par plaque + 2 écrous/rondelles pour pièce de maintient + 2écrous et rondelles plastique isolantes pour le couvercle.
ELECTRODE
- Le dimensionnement de votre électrode dépendera des dimensions de votre pot.
- D'abord sa largeur pour les plaques de métal et pièce de maintient qui vous donneront la tolérance pour l'entraxe de vos tiges filetées.
- Puis la profondeur du pot pour la longueur des tiges filetées + 3- 5cm.
Dans mon cas j'ai maximisé la largeur de mes plaques (plus grande que l'entraxe des tiges) ce qui multiplie les trous par 2, c'est pas obligatoire.
- Une fois vos dimensions déterminées percer votre pièce en bois à l'entraxe et au diamètre de vos tiges. Cette pièce permet le maintient du parallélisme entre les électrodes, l'ensemble est plus robuste que si seul le couvercle du pot assurait le maintient.
- Faite de même sur le couvercle du pot mais en perçant plus large que les tiges. Si elles font 6mm de diamètre percez à 10. Cela permet que les tiges ne rentrent pas en contact avec le couvercle qui est métallique et donc conducteur ce qui provoquerait un court circuit.
- Mettre de la colle sur la pièce de maintient (elle servira d'étanchéité), glisser vos tiges filetées à travers cette pièce et le couvercle. Faire dépasser de 3cm minimum au dessus du couvercle. Couvercle et pièce de maintient sont maintenant collé avec les tiges au travers, il faut maintenant serrer le tout avec écrou rondelle. ATTENTION coté couvercle, utiliser des pièces en plastiques isolante comme rondelle.
- A ce stade cela pourrait fonctionner mais pas idéalement.Il faut maintenant installer nos plaques pour multiplier les surfaces d'échanges.
- Découper vos plaques à dimensions.
- Reporter sur leur diamètre l'entraxe des tiges pour percer. centrer !
- Sur chaque plaque faire un trou au diamètre de la tige (6) et un à 10 voir plus grand. Un trou servira à la fixation l'autre à laisser passer l'autre tige sans la toucher.
- Maintenant il faut les fixer en quinquonce avec les écrous (2 écrous par plaque). Une + sur une tige, une - sur l'autre tige. Plus elles sont proches mieux c'est.Placer en le maximum. TESTER L'ISOLATION ENTRE VOS ELECTRODE (multimètre en position ohmètre)
TUYAU DE RECUPERATION DES GAZS
- Vous pouvez le faire passer dans la pièce de maintient (plus solide) ou juste par le couvercle.Percer au diamètre, enfiler le tuyau à l'intérieur. coller dessus/dessous. Pourquoi pas utiliser une valve de chambre air pour déconnecter le tuyau (voir bulleur)
FINITION
- Etanchéité : Mettre du tefelon sur le filetage du pot (sens horaire)
- Connecter vos fils électriques aux tiges filetées . Rondelle/fil/rondelle écrou.Serrer.
Étape 7 - Fabrication du bulleur
1 petit pot de confiture, 2 valves de chambres à air, un tuyau 5-10cm, un tuyau 30cm du tefelon
- Selon vos valves : Grande, il faut la percer. Petite elle peut servir d'antiretour (de flamme) pour le tuyau de sortie. Attention tête en bas, soufflez dedans pour tester.
- Percer le couvercle au diamètre de vos valves, insérer à mi chemin, coller dessus/dessous.
- Connecter à une valve coté intérieur le tuyau 5-10cm qui plongera dans l'eau.C'est l'arrivée des gazs depuis l'electrolyseur.
- Connecter à une valve coté extérieur le tuyau 30cm pour qu'il aille du bulleur jusqu'a votre expérience (petit pot d'eau savonneuse ou bruleur ou...)
- insérer un petit bout de mousse au bout du tuyau (anti retour de flamme)
- Etanchéité : Tefelon (sens horaire) sur le filetage du pot.
- Remplir d'eau le bulleur sans immerger la sortie des gazs.
Étape 8 - Composition de l'électrolyte
Proportion à titre indicatif..
- Revérifier l'isolation (ohmètre) entre vos deux électrodes
- Connectez votre votre circuit électrique en y placant votre ampèremère
Un grand pot de confiture contient à peu près 700ml.
- un ratio soude/eau entre 1-4% semble correct. Cela dépend aussi si vous utilisez de l'eau distillée (moins conductrice) ou pas..
- Verser 600ml d'eau distillée. L'eau normal fait l'affaire mais le systeme s'encrasse plus vite.
- Rajouter 5ml de soude, mélanger
- Immerger vos électrodes
- Le tout doit recouvrir les électrodes mais ne pas noyer le tuyau de sortie. à vous d'ajuster. Moins il y a d'air dans le pot mieux c'est (temps de purge cf dans la suite).
- Mettre sous tension (si ça coupe cf "problèmes?")
- La réaction commence, vous devriez avoir 3-4 amperes pour une alim pouvant ici 17A.
- Rajouter 1-2-3-4 ml de soude pour atteindre 7 Ampère.
- Il faut garder une marge car avec le temps le courant peut monter.
- ça y est c'est près, fermez bien votre pot.
- Pour aller plus loin, je conseille d'aller voir ce site ou ils listent les électrolytes avec avantages/inconvénients https://www.generateurhho.com/conseils-technique-truc-astuces/les-differents-electrolytes
Étape 9 - Assemblage et Test
Connecter le tuyau de l'électrolyseur au bulleur, fermer bien vos pots. Plonger le tuyau de sortie du bulleur dans un petit pot d'eau savoneuse accompagner d'une petite cuillère.
- Mettre sous tension. dès lors surveiller l'ampérage.
- Des bulles apparaissent dans l'électrolyseur puis dans le bulleur puis dans l'eau savonneuse.
- Dans une petite ceuillère récupérer des bulles.Placer sur une flamme. Les bulles éclates mais il ne se passe rien et c'est normal car elles ne contiennent pas encore d'hydrogène, le système n'a pas encore purgé son air.
- Renouveller toutes les 15 secondes, au bout d'un certain temps on détecte une mini explosion , elle s'amplifiera jusqu'a devenir très surprenante !!
Étape 10 - Utilisation dans le temps
- Les électrodes + et - se dégradent ou se salissent différemment.
- Le courant monte avec le temps, c'est normal. (surtout en 12V)
- La température de l'électrolyseur monte, c'est normal (d'autant plus en 12 V).
- Le niveau d'eau monte dans le bulleur , c'est normal c'est du à l'évaporation dans l'électrolyseur (d'autant plus en 12V).
- L'ampérage dépasse les 10 A (d'autant plus en 12 V). si vous n'avez pas de pince ampèremétrique, couper sous peine d'endommager votre multimètre.
- Le courant monte rapidemement ? on s'approche du court circuit à cause de l'encrassememnt, des christaux qui se forment.
- Le courant s'approche de la limite de l'alimentation, couper.
- NETTOYER , en électrolisant dans de l'eau pure pendant 30s-60s.
- Verifier l'isolation entre vos 2 électrodes.
Étape 11 - Pour aller plus loin
Il est possible de multiplier les électrolyseurs qu'on relie au même bulleur afin de récupérer plus d'hydrogène. Ainsi en rajoutant un bruleur au tuyau de sortie on peut faire une flamme en continu à très haute température.
Utilisation d'un gel déboucheur à la place de la lessive de soude. Cela crée une mousse stockable (dans ce cas ne pas utiliser le bulleur, en tous cas ne pas faire passer la mousse par de l'eau)
Recombiner ces gazs pour reformer de l'eau ? et fabriquer le l'électricité ? pile à combustible ... mais je crois que ça necessite d'avoir H et O séparément.
Étape 12 - En très simple pour fabrication avec des enfants
-Electrodes : crayon de papier
- Electrolyte : eau du robinet + bicarbonnate bien mélangé
- Alimentation : pile 9 V ou une vrai alimentation.
- mettre une flamme directement au dessus du récipient (a tester)
Comment ça marche ?
Observations : que voit-on ?
L'utilisation du 12 V entre les électrodes permets d'accentuer certains phénomènes qui sont problématiques mais interessant à observer ....
LES GAZS
- Les gazs circulent, ils remontent dans l'eau
- Il y a une pression, cela permet la circulation dans les tuyaux qu'ils aillent vers le haut ou vers le bas (hydrogène plus léger que l'air il devrait rester coincer lorsque le tuyau part vers le bas...). Si l'on bouche le tuyau de sortie, il n'y a plus de bulle dans le bulleur, la pression monte et l'étanchéiter est mise à l'épreuve.
-Sur les électrodes + et - il y a respectivement des bulles plus ou moins grosses qui remontent plus ou moins vite. Pas sure qu'on puisse en tirer de bonne conclusion mais vus que l'on produit 2* plus d'hydrogène que d'oxygène... que l'hydrogène est plus léger que l'oxygène...
L' EXPLOSION
- Au début les bulles n'explosent pas puis au bout d'un moment... (purge de l'air..)
- L'explosion est très impressionante comparé au volume d'une petite cuillère.
- On ne voit pas de flamme
- On sent un souffle de l'explosion
COMPORTEMENT DU SYSTEME
- L'eau ne baisse pas dans l'électrolyseur (en fait si mais c'est très lent) et pourtant on récupère de bon volume de gaz ....
- Avec le temps les électrodes + et - prennent un aspect différent.
- Les températures changent
- Les niveaux d'eau changent
- Le courant électrique change.
Mise en garde : qu'est-ce qui pourrait faire rater l'expérience ?
-Au démarrage mon alim se coupe : c'est à cause du pic de courant au démarrage. Solution: mettre en route l'alimentation avant de la plonger doucement dans l'électrolyte. Ou modifier son alimentation... (ajout d'un condensateur ? d'un rhéostat ?)
- L'électrolyse fonctionne mais il n'y a pas de bulles dans le bulleur: Outre un tuyau bouché, il n'y pas suffisamment de pression de gaz pour contrer la pression de l'eau dans le bulleur ou la résistance au passage des gazs; vérifier l'étanchéité de l'électrolyseur et/ou raccourcisser le tuyau arrivant dans le bulleur. Souvent les 2 sont liés, la pression de l'eau au dessus du tuyau dans le bulleur est trop importante pour l'étanchéité. (Pour tester l'étanchéité vous pouvez plonger le tout dans de l'eau pendant le fonctionnement,..)
- Plus de bulle dans le bulleur, de l'eau à la sortie ? Trop d'eau dans le bulleur , le tuyau de sortie est noyé.Cela peut être du à l'évaporation dut à la chaleur dans l'électrolyseur puis à la condensation dans le bulleur qui fait monter le niveau..
-L'alimentation fonctionne mais l'électrolyse ne fait plus de bulle : outre un problème de connexion le court circuit est atteind. Le courant choisit le chemin le plus facile et ne passe plus dans l'eau. Nettoyer en électrolisant de l'eau pure. vérifier l'isolation des électrodes.
Applications : dans la vie de tous les jours
- Pour les bricoleurs qui ajoutent ces systèmes à leur voiture ...
- Pour le stockage d'énergie ( surproduction d'électricité , éolien, solaire), par la suite on refait de l'électricité grace à une pile à combustible.
- Voiture à hydrogène, via pile à combustible pour moteur électrique.
- Applications industrielle.
Éléments pédagogiques
Sources et ressources
L'esprit sorcier :
https://www.youtube.com/watch?v=dUv3U9w1xz4
Très bien présenté et pédagogique MAIS bon il présente l'hydrogène par électrolyse comme "hydrogène décarbonné".. mouais.. et la question de comment on produit l'électricité ? De plus les énergies électriques dites "vertes", à un prix abordable j'insiste, reposent toujours sur la même chose le pétrole... les métaux qui sont légions dans ces technologies on va les chercher comment ? Il pourrait mettre un peu plus de nuance tout de même
C'est un peu trop "croissance verte" et technocentré mais c'est mon avis. A la fin ça nuance un peu mais bon faut aller au bout de la vidéo.
Alimentation tour de PC
https://www.latelierdugeek.fr/2013/05/11/transformer-une-alimentation-de-pc-en-alimentation-datelier
Vidéo générateur hydrogène fait maison + quelques infos en chimie
https://www.youtube.com/watch?v=Uz0REdjpJtI
Electrolyte et autres (pour aller loin..)
https://www.generateurhho.com/conseils-technique-truc-astuces/les-differents-electrolytes
Applications industrielle et autres:
https://fr.wikipedia.org/wiki/Hydrog%C3%A8ne
Dernière modification 11/03/2023 par user:Antonydbzh.
Published