| (2 révisions intermédiaires par 2 utilisateurs non affichées) | |||
| Ligne 19 : | Ligne 19 : | ||
}}{{ItemList | }}{{ItemList | ||
|Item=Verre | |Item=Verre | ||
| + | }} | ||
| + | |Tuto_Attachments={{Tuto Attachments | ||
| + | |Attachment=Oeuf_qui_ramollit_Wikidebrouillard-Oeuf_qui_ramollit.pdf | ||
}} | }} | ||
}} | }} | ||
| Ligne 25 : | Ligne 28 : | ||
|Step_Content=- 1 oeuf | |Step_Content=- 1 oeuf | ||
| − | - 1 | + | - 1 récipient |
- Vinaigre blanc | - Vinaigre blanc | ||
| Ligne 31 : | Ligne 34 : | ||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title= | + | |Step_Title=Réaliser l'expérience |
|Step_Content=*Mets l'œuf dans le verre | |Step_Content=*Mets l'œuf dans le verre | ||
*Ajoute du vinaigre pour que la totalité de l'œuf baigne dedans. | *Ajoute du vinaigre pour que la totalité de l'œuf baigne dedans. | ||
| Ligne 57 : | Ligne 60 : | ||
*regarde-le à la lumière | *regarde-le à la lumière | ||
| − | * | + | *appuie dessus |
*découpe-le ! | *découpe-le ! | ||
*etc. | *etc. | ||
Version actuelle datée du 22 mai 2020 à 11:29
Introduction
- Matériel et outils
- Fichiers
Étape 2 - Réaliser l'expérience
- Mets l'œuf dans le verre
- Ajoute du vinaigre pour que la totalité de l'œuf baigne dedans.
- Attends une journée ou une nuit !
Étape 3 - Observer ce qu'il se passe
Tu peux déjà voir quelque chose se passer dans le verre. On voit des petites bulles qui se forment sur la coquille de l’œuf !
Étape 4 - Observer le résultat
- Frotte délicatement l'oeuf sous l'eau du robinet
- Prends l'œuf dans les mains et observe sa texture
Étape 5 - Pour aller plus loin
Fais des tests !
- regarde-le à la lumière
- appuie dessus
- découpe-le !
- etc.
Comment ça marche ?
Observations : que voit-on ?
L'œuf semble avoir perdu sa coquille. Il est malléable et on peut enlever sa coquille, qui est devenue poudreuse, juste en le frottant. Lorsqu'on l'ouvre, on observe bien une peau qui contient le blanc et le jaune d'œuf.
Explications
La coquille de l’œuf a été dissoute par le vinaigre. La coquille est principalement faite de calcaire (carbonate de calcium, CaCO3).
Comme le bicarbonate, le carbonate de calcium va réagir avec le vinaigre ou d'autres acides.
La réaction chimique produit également du CO2 (dioxyde de carbone), c'est la raison pour laquelle on peut observer des bulles à la surface de l’œuf et dans le verre.
Le pigment qui donne sa couleur à l'œuf ne se dissout pas et reste collé à la paroi de l'œuf, c'est pour cela qu'il est rose. En revanche, il n'est plus solidaire du carbonate de calcium qui formait la coquille et un simple frottement permet de le retirer.
Plus d'explications
1/ Lorsque l’on plonge un œuf dans du vinaigre, il se produit une réaction chimique. La coquille. est constituée de carbonate de calcium. C’est le principal composant du calcaire. Il est insoluble dans l’eau et heureusement car sinon cuire un œuf ne serait pas de tout repos ! Le vinaigre contient un acide : c'est l’acide acétique (sa concentration est indiquée généralement sur la bouteille en %). L'acide acétique du vinaigre réagit avec le carbonate de calcium.
Acide acétique + carbonate de calcium -----> gaz carbonique + eau + bicarbonate de calcium
CH3COOH + CaCO3 -----> CO2 + H2O + Ca (CH3COO)2
Il y a donc également production d’eau et de bicarbonate de calcium. Ce dernier est soluble dans l’eau et donc ne se remarque pas à l’œil nu. Il est présent sous forme d’ions Ca(II) et d’ions bicarbonates.
2/ Lorsque la totalité du carbonate de calcium a été consommé, la réaction s’arrête. Il ne reste alors plus que la membrane de l’œuf pour contenir le jaune et le blanc. La couleur de la coquille n’a cependant pas disparu car les pigments n’ont pas été dissous au cours de la réaction. Ils se sont donc naturellement déposés sur cette membrane. Ils ne sont toutefois pas solidaires de cette dernière et le fait de simplement frotter le couteau dessus permet de les retirer.
On a alors l’impression d’avoir obtenu un œuf dur. Mais si l’on tient cet œuf entre les mains, on constate que celui-ci reste assez malléable et semble contenir un liquide.
Pour confirmer cette hypothèse, on déchire cette membrane. Le jaune et le blanc de l’œuf sont bien encore liquides. L’intérieur de l’œuf est intact ? Pas si sûr…
Si on compare le pH du blanc de l’œuf de l’expérience avec celui d’un œuf intact, on constate qu’il est moins élevé dans le premier cas, ce qui indique que du vinaigre est entré. Il semblerait donc que la membrane ne soit pas si imperméable que ça. Cette membrane, est "hémiperméable", elle laisse passer un certain nombre d'éléments, dont des gaz nécessaires à la respiration de l'oeuf (en effet quand le foetus se céveloppe, il respire, c'est à dire qu'il rejette du CO2 et absorbe de l'O2) .
En principe, on pourrait donc cuire un œuf juste avec du vinaigre. Pour s’en assurer il est possible de faire l’expérience suivante : verser le contenu d’un œuf dans un récipient et y ajouter du vinaigre. On observe alors la formation de filaments blancs. L’œuf coagule (comme lorsqu’on le cuit). Si on le laisse suffisamment longtemps (au moins 5 jours), la totalité de l’œuf aura coagulé.
Troublant, non ?!
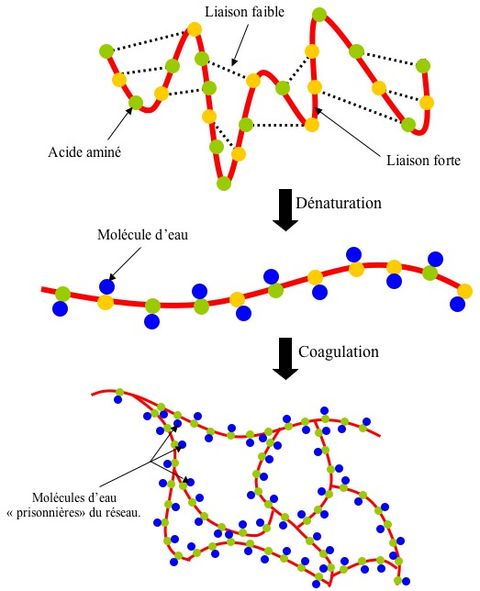
4/ Pas tant que ça quand on sait que l’œuf est principalement constitué de protéines comme l’ovalbumine. En effet, ces protéines sont constituées d’acides aminés attachés ensemble par des liaisons covalentes (fortes). Leur forme tridimensionnelle est assurée par des liaisons faibles de différente nature. Or le fait d’abaisser le pH rompt un certain nombre de ces liaisons (dénaturation) et permet à cette chaîne de prendre une forme linéaire. Cette nouvelle structure rend possible certaines interactions avec d’autres molécules (elle a en quelque sorte « les bras libres »). Et notamment l’eau avec laquelle elle s’associe par l’intermédiaire de ponts disulfures (coagulation). L’interaction entre ces différentes chaînes construit un réseau qui emprisonne les molécules d’eau et rigidifie l’œuf.
5/ En revanche si vous faites cette expérience qui demande vraiment beaucoup de patience et de précautions, vous constaterez que l’œuf cuit de cette manière n’a pas vraiment un aspect très comestible. Pourtant il l’est !
Applications : dans la vie de tous les jours
On peut utiliser le vinaigre pour détartrer une cafetière, ou nettoyer le calcaire dans la salle de bain !
On peut également cuire l’œuf de cette manière, en le laissant longtemps dans le vinaigre.
Vous aimerez aussi
Sur le wikidébrouillard :
Gonfler un ballon sans souffler
Éléments pédagogiques
Objectifs pédagogiques
- Découvrir le principe d'une réaction chimique
- Comprendre la composition d'un objet commun : un oeuf
Pistes pour animer l'expérience
Un ou plusieurs œufs devront être plongés dans le vinaigre 48h avant l'atelier de façon à ce que les participants puissent découvrir le résultat de l'expérience.
Sources et ressources
Structure et formation de l'oeuf de poule sur Wikipedia
Dernière modification 22/05/2020 par user:Bolido.
Published