| Ligne 103 : | Ligne 103 : | ||
https://www.phychiers.fr/concentrations/ | https://www.phychiers.fr/concentrations/ | ||
| − | |Applications= | + | |Applications=Les polluants qui s'évaporent peuvent ensuite retomber, entrainés par la pluie et être être retrouvés à des kilomètres de l'endroit où ils ont été relâchés ! [2] Un élément chimique peut donc polluer plusieurs milieux s’il est amené à s’évaporer. D'autres se transforment une fois dans l'atmosphère et peuvent créer d'autres formes de pollution, comme les pluies acides. [3] |
Plus un polluant est concentré, plus il risque de faire des dégâts. Pour les organismes vivants, une plus grande concentration signifie plus de probabilité de rencontrer ce polluant. | Plus un polluant est concentré, plus il risque de faire des dégâts. Pour les organismes vivants, une plus grande concentration signifie plus de probabilité de rencontrer ce polluant. | ||
| − | Une expérience simple permet de mettre en évidence | + | Une expérience simple permet de mettre en évidence ce principe : Verser une dizaine de grains de riz (ou autre) dans une assiette plate puis fermer les yeux et toucher du doigt au hasard. Le risque de tomber sur un grain de riz est assez faible. Transvaser dans un verre ou une tasse et recommencer. La concentration des grains et beaucoup plus élevée et le risque d'en toucher au moins un également. |
|Related=* [[Bon état écologique]] | |Related=* [[Bon état écologique]] | ||
* [[Les pollutions invisibles]] | * [[Les pollutions invisibles]] | ||
| Ligne 126 : | Ligne 126 : | ||
[https://www.ligair.fr/la-pollution/les-influences-meteorologiques <nowiki>[2] https://www.ligair.fr/la-pollution/les-influences-meteorologiques</nowiki>] | [https://www.ligair.fr/la-pollution/les-influences-meteorologiques <nowiki>[2] https://www.ligair.fr/la-pollution/les-influences-meteorologiques</nowiki>] | ||
| − | https://www. | + | [https://www.geo.fr/environnement/quest-ce-quune-pluie-acide-definition-et-dangers-193897 <nowiki>[3] https://www.geo.fr/environnement/quest-ce-quune-pluie-acide-definition-et-dangers-193897</nowiki>] |
https://www.phychiers.fr/concentrations/ | https://www.phychiers.fr/concentrations/ | ||
Version du 13 mai 2023 à 15:21
Sommaire
- 1 Introduction
- 2 Étape 1 - Préparation du matériel
- 3 Étape 2 - Préparation des différentes « eaux »
- 4 Étape 3 - Évaporation : eau + vinaigre
- 5 Étape 4 - Test de présence : eau + vinaigre
- 6 Étape 5 - Évaporation : eau + colorant alimentaire
- 7 Comment ça marche ?
- 8 Éléments pédagogiques
- 9 Commentaires
Introduction
Lorsque l'eau s'évapore, que deviennent les éléments qu'elle contient ? Est-ce que la pollution disparait ? Découvrons-le ensemble !
- Matériel et outils
- Expériences pré-requises
En chimie, les groupement d'atomes dont l'absorption lumineuse cause la couleur s'appelle un chromophore. Un colorant soluble se désigne comme teinture, sinon c'est un pigment.
Dans les techniques d'application, comme la pharmacie ou la cuisine, un colorant peut contenir une combinaison de molécules solubles et de particules insolubles. En biologie, on parle de pigments plus que de colorants, dans tous les cas.Étape 1 - Préparation du matériel
- Rassembler le matériel nécessaire à l’expérience ;
- Pour la fabrication du jus de chou rouge : https://www.wikidebrouillard.org/wiki/Liquide_qui_change_de_couleur.
Étape 2 - Préparation des différentes « eaux »
Pour cette expérience, nous allons comparer l’évaporation de deux eaux "polluées" : Une mélangée à du vinaigre et une avec du colorant alimentaire.
- Mélanger un petit verre de vinaigre blanc avec 4 verres d’eau du robinet ;
- Mélanger 5 verres d’eau du robinet avec quelques gouttes de colorant alimentaire (suffisamment pour que l’eau soit bien colorée).
- Garder un peu de chacune des deux eaux de côté, dans des verres séparés.
Étape 3 - Évaporation : eau + vinaigre
- Mimer l’évaporation liée au soleil : chauffer le mélange eau-vinaigre sur la plaque électrique (attention, la présence d’un adulte est fortement conseillée pour cette étape) ;
- Lorsque le mélange commence à bouillir, placer le coton au dessus à l’aide de la pince ;
- Rester quelques minutes au dessus de la casserole, jusqu’à ce que le coton soit un peu humide.
Attention : l’odeur de vinaigre chauffé peut être très forte. Penser à aérer la pièce lors de l’expérience ou à la réaliser en extérieur.
Étape 4 - Test de présence : eau + vinaigre
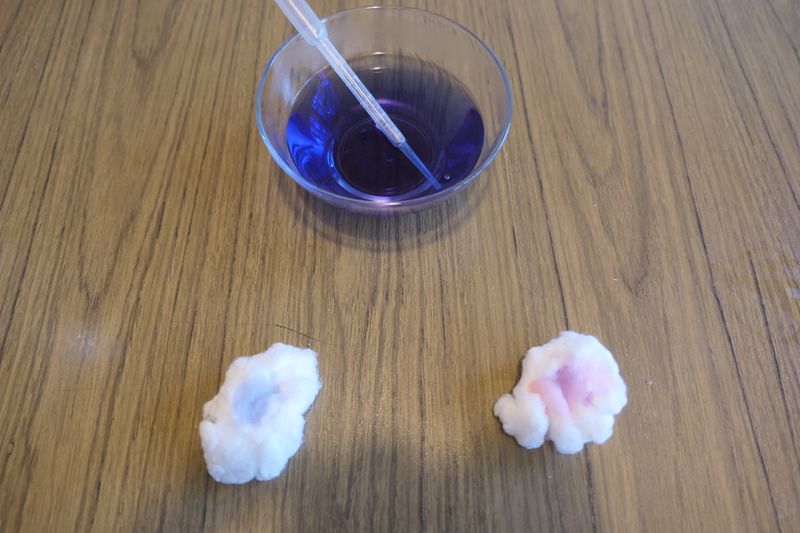
Pour tester la présence de vinaigre sur le coton, déposer quelques gouttes de jus de chou rouge sur le coton.
Pour comparer, on peut déposer quelques gouttes sur un autre coton.
Observer la coloration du jus de chou rouge sur le coton qui a servi à l'expérience.
Étape 5 - Évaporation : eau + colorant alimentaire
- Mimer l’évaporation liée au soleil : chauffer le mélange eau-colorant sur la plaque électrique (attention, la présence d’un adulte est fortement conseillée pour cette étape) ;
- Lorsque le mélange commence à bouillir, placer le coton au dessus à l’aide de la pince ;
- Rester quelques minutes au dessus de la casserole, jusqu’à ce que le coton soit un peu humide.
- Observer la couleur du coton.
- Verser le reste de l'eau "polluée" dans un verre. Attention, elle est bouillante !
Comment ça marche ?
Observations : que voit-on ?
- Lors de l'expérience avec le vinaigre, on observe que le jus de chou rouge devient rose lorsque qu’on le dépose sur le coton. Ce changement de couleur est lié à la présence de vinaigre (acide) sur le coton ;
- Lors de l'expérience avec le colorant alimentaire, on n’observe pas de coloration du coton. Quand on compare l'eau pollué évaporée avec l'eau polluée qu'on a mise de côté, la couleur semble s'être accentuée avec l'évaporation.
Mise en garde : qu'est-ce qui pourrait faire rater l'expérience ?
- Ne pas rester suffisamment longtemps au dessus de la casserole avec le coton ou le placer trop tard (après que l'ébullition ait commencé).
- Utiliser un acide autre que du vinaigre et qui ne s'évaporerait pas.
Explications
Dans le cas du vinaigre, il s’évapore en même temps que l’eau lorsque le mélange est chauffé. L’élément polluant, ici représenté par le vinaigre, se retrouve dans l’air. Il peut ensuite se déplacer et atteindre les nuages (ici, le coton).
Le colorant alimentaire, lui, reste dans la casserole tandis que l'eau s'évapore. À la fin de l'expérience, il reste une grande quantité de colorant dans une très petite quantité d'eau. On observe alors une couleur plus foncée, comme si on avait ajouté plus de colorant au début.
Plus d'explications
Pour évaporer l'eau, on la porte à ébullition. C'est la température à partir de laquelle l'eau passe sous sa forme gazeuse. Pourtant dans la nature l'eau atteint rarement les 100°C et on constate de l'évaporation ! En réalité, le vent facilite grandement ce phénomène, notamment quand l'air est sec. [1]
Dans le cas où un composé peut s'évaporer et se retrouver dans l'atmosphère, on dit qu’il est volatil. Les polluants volatils peuvent être très compliqués à traiter car selon la météo, ils peuvent s'échapper et apparaitre à d'autres endroit.
Lorsque les polluants ne peuvent pas s'évaporer, leur concentration va augmenter. Ce simulateur permet de s'amuser avec les concentrations pour comprendre le phénomène :
https://www.phychiers.fr/concentrations/
Applications : dans la vie de tous les jours
Les polluants qui s'évaporent peuvent ensuite retomber, entrainés par la pluie et être être retrouvés à des kilomètres de l'endroit où ils ont été relâchés ! [2] Un élément chimique peut donc polluer plusieurs milieux s’il est amené à s’évaporer. D'autres se transforment une fois dans l'atmosphère et peuvent créer d'autres formes de pollution, comme les pluies acides. [3]
Plus un polluant est concentré, plus il risque de faire des dégâts. Pour les organismes vivants, une plus grande concentration signifie plus de probabilité de rencontrer ce polluant.
Une expérience simple permet de mettre en évidence ce principe : Verser une dizaine de grains de riz (ou autre) dans une assiette plate puis fermer les yeux et toucher du doigt au hasard. Le risque de tomber sur un grain de riz est assez faible. Transvaser dans un verre ou une tasse et recommencer. La concentration des grains et beaucoup plus élevée et le risque d'en toucher au moins un également.
Vous aimerez aussi
- Bon état écologique
- Les pollutions invisibles
- Plantes et biocides
- La pollution de l'eau par lessivage
Éléments pédagogiques
Objectifs pédagogiques
- Mettre en évidence le processus d’évaporation ;
- Comparer les résultats de plusieurs expériences ;
- Comprendre le phénomène de concentration.
Pistes pour animer l'expérience
Il est possible de remplacer le colorant alimentaire par un acide non volatil, comme le jus de citron. En fin d'expérience, on comparera alors l'évolution du pH (par la couleur du jus de chou rouge, par exemple) dans les deux eaux initiales. Celle avec le vinaigre aura perdu son acidité, alors que le pH de l'eau citronné aura légèrement baissé.
Pour concrétiser la notion de concentration, on peut verser du sucre dans un petit volume d'eau et goûter. Ensuite, verser ce volume d'eau dans une grande bouteille et la remplir d'eau. Dans le premier cas, l'eau est sucrée, dans le second elle ne l'est plus. La quantité de sucre reste la même, mais le volume augmente. Puisque la concentration et la quantité divisée par le volume, celle-ci diminue !
Sources et ressources
[1] https://www.aquaportail.com/definition-3736-evaporation.html
[2] https://www.ligair.fr/la-pollution/les-influences-meteorologiques
[3] https://www.geo.fr/environnement/quest-ce-quune-pluie-acide-definition-et-dangers-193897
https://www.phychiers.fr/concentrations/
Dernière modification 16/05/2023 par user:Quentin G..
Draft