| Ligne 80 : | Ligne 80 : | ||
===Acidification des océans=== | ===Acidification des océans=== | ||
| + | Selon les données réunies par l’OMM en 2013-2014, l'océan mondial absorbe actuellement un quart environ des émissions anthropiques de CO<sub>2</sub>. Cette capacité semble se dégrader en raison des effets combinés du réchauffement et de l'acidification qui affectent la production et la fixation de carbonates par les organismes calcaires marins. Or, ce sont ces organismes marins, en absorbant le CO2, qui jouent le rôle du principal puit de carbone planétaire. | ||
| + | |||
| + | |||
| + | Le CO2, ou dioxyde de carbone, acidifie l’eau de mer, c’est à dire qu’il fait diminuer son pH. Or, l'eau de mer a un pH légèrement basique, autour de 8 (8.15 en 1950 et 8.05 en 2021). La réduction du pH de l'eau de mer (c'est-à-dire l'augmentation du taux de protons H<sup>+</sup>) est à l'origine des difficultés de calcification apparues chez les organismes calcaires. Quand le CO2 se dissous, plusieurs réactions chimiques se produisent. Le CO<sub>2</sub> se combine avec l'eau, en formant de l'acide carbonique (H<sub>2</sub>CO<sub>3</sub>). L’acide carbonique, instable, se dissocie directement en ions bicarbonate (HCO<sub>3</sub><sup>-</sup>) et H<sup>+</sup> (H<sub>2</sub>CO<sub>3</sub> -> HCO<sub>3</sub><sup>-</sup> + H<sup>+</sup>). La libération d’ions H<sup>+</sup> provoque une augmentation de l'acidité, autrement dit le pH diminue. Beaucoup des ions H<sup>+</sup> libérés s'associent avec des ions carbonate (CO<sub>3</sub><sup>2-</sup>) présents naturellement dans l'eau et forment des ions bicarbonate (H<sup>+</sup> + CO<sub>3</sub><sup>2-</sup> -> HCO<sub>3</sub><sup>-</sup>). Donc plus le pH diminue plus la concentration en ions carbonate de l'eau de mer diminue également. Donc, lorsque les organismes calcifiants se trouvent dans un milieu appauvri en ions carbonate, leurs coquilles deviennent plus fragiles, ils mettent plus de temps à les construire, et les larves souffrent plus souvent de malformations. | ||
| + | |||
| + | |||
| + | L'acidification des océans a entraîné une diminution du pH de l'eau de mer, qui est en moyenne 30 % plus acide aujourd'hui que dans les années 1800. On observe déjà un impact sur les organismes calcifiants : on a par exemple constaté un ralentissement de la croissance des huîtres ou des moules, ce qui affecte aussi les élevages. Dans certaines régions du globe, l'eau de mer est même devenue corrosive pour de petits organismes calcifiés du plancton, comme les ptéropodes, qui représentent la base des chaînes alimentaires, et qui se raréfient. | ||
===Maladies respiratoires=== | ===Maladies respiratoires=== | ||
Version du 14 février 2025 à 18:54

Enquête santé
Jeu de piste faisant le lien entre adaptation au changement climatique et santé, autour de 5 pôles : effet de serre, CO2, pollution de l'air, pollution de l'eau et biodiversité Les participant.e.s naviguent d'un pôle à l'autre, expérimentent et réalisent des défis. Il est conseillé d'encadrer ce parcours avec deux animateur.ice.s
Déroulé
En cours de rédaction.
Parcours pédagogique réalisé dans le cadre du Feder acculturation climatique, avec pour but de repenser les expériences des Petits Débrouillards avec un axe adaptation.
Enquête santé : jeu de piste
Présentation d'un scénario d'introduction au jeu de piste
Exemple :
Un signal d'alerte vient de l'Observatoire Planétaire : la planète est en surchauffe, et met en danger ses habitant.e.s
Les enfants doivent explorer différentes zones, pour recueillir des indices, réaliser des défis et trouver des solutions pour s'adapter au nouvel environnement.
Avant l'intervention, préparer tables avec fiches et matériel à disposition.
Jeu de piste : Défis par groupe
Répartition en groupes
Chaque groupe aura a sa charge une ou deux fiches, présentant une hypothèse a vérifier, le matériel et les manipulations à réaliser. A la fin du défi, les participant.e.s pourront valider (ou non) l'hypothèse proposée, leur permettant d'obtenir des pièces de puzzle, représentant des solutions d'adaptation au changement climatique.
Fiches défis : voir fichier pdf (en cours de rédaction).
- Temps-tation : expériences sur l'effet de serre et l'albedo
- CO2 vs Planète : acidification des océans
- A l'Air'te ! : expérience et jeu autour de la pollution de l'air et des allergies
- Eau secours : expériences autour des dangers de l'eau (pollution et érosion)
- Mangez bio(diversité) ! : rôle des levures et des vitamines
Pour conclure le jeu de piste :
Proposer un débat mouvant à la fin du jeu de piste.
Ex. Est-ce que les plantes peuvent ralentir la pollution dans les sols ? Est-ce que les avancées scientifiques (médecine, bâtiments passifs, ....) permettront de nous maintenir en bonne santé malgré le réchauffement climatique ? etc.
En complément
Ce jeu de piste peu être prévu pour compléter un diagnostic climatique (relevés qualité de l'air , température, humidité, CO2) d'une structure
Notions abordées
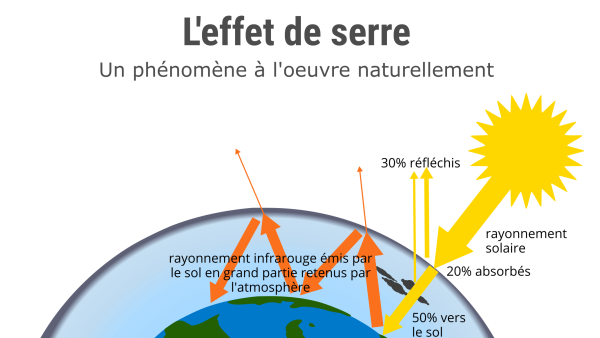
Effet de serre
L'effet de serre est un phénomène d'absorption et de réémission d'une partie du rayonnement infrarouge reçu du soleil et de la Terre.
Il s'agit d'un phénomène naturel important pour la survie de la planète. Il permet d'avoir une température moyenne sur Terre de 15° C contre -18°C si cet effet n'existait pas.
Les gaz à effet de serre sont naturellement peu abondants dans l’atmosphère mais du fait de l’activité humaine, la concentration de ces gaz s’est sensiblement modifiée (la concentration de CO2 a augmenté de 30% depuis une centaine d’années). Ces gaz absorbent le rayonnement infrarouge émis par la surface et réémettent ce rayonnement vers le haut comme vers le bas : le rayonnement réémis vers le bas s'ajoute au rayonnement solaire. Le bilan global est que la température au sol augmente au fur et à mesure qu'augmente la concentration de l'atmosphère en gaz à effet de serre. Le GIEC utilise le terme de forçage radiatif pour décrire l’influence des gaz à effet de serre sur le bilan thermique de la Terre.
Albedo
Lorsqu’une surface est exposée à la lumière du soleil ou à autre une source lumineuse chaude, elle renvoie une partie la chaleur contenue dans les rayons lumineux (= elle réfléchit une partie de la lumière). Mais elle absorbe aussi une partie de la chaleur, ce qui augmente sa température. Cette augmentation de température sera plus ou moins importante selon la couleur et la matière de la surface éclairée. Les surfaces de couleur claire réfléchissent plus la lumière, et donc accumulent moins vite la chaleur que les surfaces sombres. Ce phénomène est appelé « albédo ».
Certains matériaux, comme la pierre ou le bitume qui recouvre les routes, absorbent et conservent plus longtemps la chaleur que d’autres matériaux comme le papier, le tissu ou le bois.
L'albédo est une grandeur sans dimension, et a une valeur comprise entre 0 et 1 : un corps noir parfait, qui absorberait toutes les longueurs d'onde sans en réfléchir aucune, aurait un albédo nul, tandis qu'un miroir parfait, qui réfléchirait toutes les longueurs d'onde, sans en absorber une seule, aurait un albédo égal à 1.
Acidification des océans
Selon les données réunies par l’OMM en 2013-2014, l'océan mondial absorbe actuellement un quart environ des émissions anthropiques de CO2. Cette capacité semble se dégrader en raison des effets combinés du réchauffement et de l'acidification qui affectent la production et la fixation de carbonates par les organismes calcaires marins. Or, ce sont ces organismes marins, en absorbant le CO2, qui jouent le rôle du principal puit de carbone planétaire.
Le CO2, ou dioxyde de carbone, acidifie l’eau de mer, c’est à dire qu’il fait diminuer son pH. Or, l'eau de mer a un pH légèrement basique, autour de 8 (8.15 en 1950 et 8.05 en 2021). La réduction du pH de l'eau de mer (c'est-à-dire l'augmentation du taux de protons H+) est à l'origine des difficultés de calcification apparues chez les organismes calcaires. Quand le CO2 se dissous, plusieurs réactions chimiques se produisent. Le CO2 se combine avec l'eau, en formant de l'acide carbonique (H2CO3). L’acide carbonique, instable, se dissocie directement en ions bicarbonate (HCO3-) et H+ (H2CO3 -> HCO3- + H+). La libération d’ions H+ provoque une augmentation de l'acidité, autrement dit le pH diminue. Beaucoup des ions H+ libérés s'associent avec des ions carbonate (CO32-) présents naturellement dans l'eau et forment des ions bicarbonate (H+ + CO32- -> HCO3-). Donc plus le pH diminue plus la concentration en ions carbonate de l'eau de mer diminue également. Donc, lorsque les organismes calcifiants se trouvent dans un milieu appauvri en ions carbonate, leurs coquilles deviennent plus fragiles, ils mettent plus de temps à les construire, et les larves souffrent plus souvent de malformations.
L'acidification des océans a entraîné une diminution du pH de l'eau de mer, qui est en moyenne 30 % plus acide aujourd'hui que dans les années 1800. On observe déjà un impact sur les organismes calcifiants : on a par exemple constaté un ralentissement de la croissance des huîtres ou des moules, ce qui affecte aussi les élevages. Dans certaines régions du globe, l'eau de mer est même devenue corrosive pour de petits organismes calcifiés du plancton, comme les ptéropodes, qui représentent la base des chaînes alimentaires, et qui se raréfient.
Maladies respiratoires
Allergies
Filtration de l'eau par le sol
Erosion
Services écosystémiques
Objectifs
Travail en équipe et collaboration entre les groupes
Répondre à une hypothèse par la manipulation
Vivre une démarche scientifique
Comprendre l'impact des changements climatiques et de la pollution sur notre santé
Explorer des solutions d'adaptation au changement climatique qui protègent notre santé